E óxido É um composto químico que surge das combinações de um elemento metálico ou não metálico com o oxigênio. Por exemplo: óxido de cálcio (combinação entre cálcio e oxigênio), dióxido de enxofre (combinação entre enxofre e oxigênio).
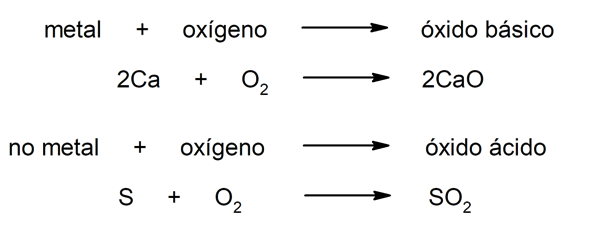
Os óxidos geralmente são formados quando elementos químicos se combinam com ar ou água, que possuem grande presença de oxigênio, o que causa desgaste nos elementos, principalmente quando se trata de metais. Para remediar isso, substâncias antioxidantes são frequentemente usadas.
Dentro dos óxidos, um classificação de acordo com o elemento com o qual o oxigênio é combinado:
- Óxidos básicos. São compostos químicos obtidos pela combinação de um elemento metálico com o oxigênio.
- óxidos ácidos. São compostos químicos obtidos a partir da combinação de um elemento não metálico com o oxigênio.
- óxidos anfóteros. Eles são formados por um elemento anfótero e oxigênio, portanto, esses óxidos atuam como ácidos ou bases, dependendo da reação em que estão envolvidos.
Para nomear esse tipo de substância, existem três formas possíveis de fazê-lo, como veremos a seguir.
- Pode servir para você: Ligas
La nomenclatura tradicional (o estequiométrica)
Adiciona uma série de prefixos e sufixos ao nome do elemento (metálico ou não metálico) dependendo do número de números de oxidação que possui.
Além disso, se for um óxido básico escreve-se ‘óxido de (nome do metal com seus respectivos prefixos e sufixos)’ e se for um óxido ácido costuma-se escrever também ‘anidrido (nome do metal com seus respectivos prefixos e sufixos)’.
Quando o elemento tem apenas um número de oxidação:
- ‘ óxido (e o elemento com o sufixo -ico)’. Por exemplo: óxido potásico (K2O).
Quando o elemento tem dois números de oxidação:
- Para o maior número de oxidação: ‘óxido (e o elemento com o sufixo -ico)’. Por exemplo: óxido férrico (Fe2O3)
- Para o menor número de oxidação: ‘óxido (e o elemento com o sufixo -oso)’. Por exemplo: óxido ferroso (FeO).
Quando o elemento tem três números de oxidação:
- Para o menor número de oxidação: ‘óxido (e o elemento com o prefixo ‘hypo’ e o sufixo -oso)’. Por exemplo: anidrido hipossulfurado (SO)
- Para o número de oxidação intermediário: ‘óxido (e o elemento com o sufixo -oso) Por exemplo: dióxido de enxofre (SO2).
- Para o maior número de oxidação: ‘óxido (e o elemento com o sufixo -ico). Por exemplo: anidrido sulfúrico (SO3). Neste caso usamos a palavra ‘anidrido’ porque o enxofre é um não-metal, já que estamos falando de óxidos ácidos.
Quando o elemento tem quatro números de oxidação :
- Para o menor número de oxidação: ‘óxido (e o elemento com o prefixo hipo- e o sufixo -oso)’. Por exemplo: anidrido hipocloroso (Cl2O).
- Para o número de oxidação que segue: ‘óxido (e o elemento com o sufixo -oso). Por exemplo: anidrido cloroso (Cl2O3).
- Para o seguinte número de oxidação: ‘óxido (e o elemento com o sufixo anexado ‘ico’)’. Por exemplo: anidrido clorídrico (Cl2O5).
- Para o maior número de oxidação: ‘óxido (e o elemento com o prefixo ‘per’ e o sufixo ‘ico’)’. Por exemplo: óxido perclórico (Cl2O7).
nomenclatura sistemática
Essa nomenclatura é mais simples que o tradicional e o óxido é nomeado escrevendo a palavra ‘óxido de’ e depois o nome do elemento, mas escrevendo antes de cada um deles o prefixo que corresponde ao número de átomos que ele possui naquele composto químico.
O prefixo mono- é para um único átomo, o prefixo di- para dois, o prefixo tri- para três, o prefixo tetra- para quatro, o prefixo penta- para cinco, o prefixo hexa- para seis, o prefixo hepta- para sete e o prefixo octa- para oito.
- Neste grupo são registrados, por exemplo: a monóxido de dicobre (Cu2O)a trióxido de dialumínio (Al2O3)a dióxido de carbono (CO2)ou o monóxido de diflúor (F2O).
Nomenclatura de ações
A palavra “óxido” é escrita, seguida do nome do metal e o número de oxidação com o qual ele trabalha, entre parênteses e em algarismos romanos. Analogamente à nomenclatura tradicional, escrever-se-á:
- óxido de cloro (I) para óxido hipocloroso (Cl2O)
- óxido de cloro (III) para óxido de cloro (Cl2O3)
- óxido de cloro (V) para óxido de cloro (Cl2O5)
- óxido de cloro (VII) para óxido perclórico (Cl2O7)
- Como são chamados os ácidos?
- Como são formados os hidróxidos?
- De onde é obtido o chumbo?
