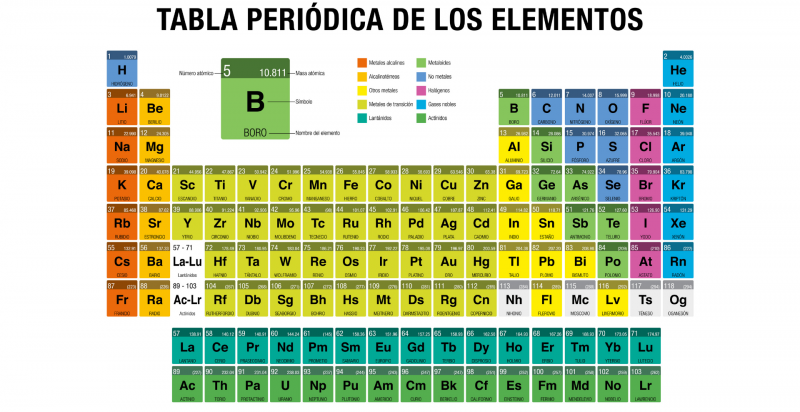
o Tabela Periódica dos Elementos É uma mesa na qual estão dispostos todos os elementos químicos conhecidos pelo homem, dispostos de acordo com seu número atômico (número de prótons), configuração eletrônica e propriedades químicas específicas.
Trata-se de uma ferramenta conceitual essencial para o estudo da matéria cuja primeira versão foi publicada em 1869 pelo químico russo Dmitri Mendeleev, e que foi sendo atualizada ao longo dos anos, à medida que novos elementos químicos foram descobertos e os padrões subjacentes às suas propriedades foram melhor compreendidos.
A tabela periódica atual está estruturada em sete linhas (horizontal) chamados períodos e em 18 colunas (vertical) chamados grupos ou famílias. Os elementos químicos são organizados de acordo com suas propriedades da esquerda para a direita ao longo dos períodos e de cima para baixo seguindo cada grupo.
Algum propriedades de elementos químicos, como raio atômico e raio iônico, aumentam de cima para baixo (seguindo o grupo) e da direita para a esquerda (seguindo o período), enquanto a energia de ionização, afinidade eletrônica e eletronegatividade aumentam de baixo para cima (seguindo o grupo) e da esquerda para a direita (seguindo o ponto).
- Pode servir para você: Compostos orgânicos e inorgânicos
Grupos da tabela periódica
Numerados de 1 a 18 da esquerda para a direita, os nomes atuais dos grupos são determinados pelo nomenclatura IUPAC , aprovado em 1988 para unificar as várias formas de nome que existiam. Os elementos que compõem cada grupo possuem configurações eletrônicas semelhantes e a mesma valência (número de elétrons na última órbita), portanto, possuem propriedades químicas semelhantes.
Segundo a IUPAC, existem os seguintes grupos de elementos:
- Grupo 1 (IA). Neste grupo estão todos os metais alcalinos, com exceção do hidrogênio, que embora esteja nominalmente no grupo, é um gás. Os elementos fazem parte da família: lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs), frâncio (Fr). Eles têm densidades muito baixas, são bons transmissores de calor e eletricidade e nunca são encontrados livremente na natureza, mas em compostos com outros elementos.
- Grupo 2 (IIA). Neste grupo estão os chamados metais alcalino-terrosos, são mais duros que os metais alcalinos, brilhantes e bons condutores elétricos, embora menos reativos e muito bons redutores (oxidantes). A família é composta por: berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra).
- Grupo 3 (IIIB). A família do escândio está neste grupo, embora em muitos dos grupos do bloco “d” da tabela (grupos 3 a 12, incluindo actinídeos e terras raras) não haja um consenso definitivo quanto ao arranjo ideal. Eles compõem esta família: escândio (Sc), ítrio (Y), lantânio ou lutécio (La) e actínio (Ac), são sólidos, brilhantes e altamente reativos, semelhantes em propriedades ao alumínio. As chamadas “terras raras” também pertencem a esse grupo: os lantanídeos (ou lantanóides). Os actinídeos (ou actinóides) também pertencem a este grupo. Ambos os conjuntos de elementos (os lantanídeos e os actinídeos) são chamados de “elementos de transição interna” e estão em um bloco inferior da tabela. Os lantanídeos são: lantânio (La), cério (Ce), praseodímio (Pr), neodímio (Nd), promécio (Pm), samário (Sm), európio (Eu), gadolínio (Gd), térbio (Tb), disprósio ( Dy), Hólmio (Ho), Érbio (Er), Túlio (Tm), Itérbio (Yb), Lutécio (Lu). Os actinídeos são: actínio (Ac), tório (Th), protactínio (Pa), urânio (U), neptúnio (Np), plutônio (Pu), amerício (Am), cúrio (Cm), berquélio (Bk), califórnio (Cf), einstênio (Es), férmio (Fm), mendelévio (Md), nobélio (No) e laurêncio (Lr). A partir do neptúnio, estes são isótopos instáveis produzidos pelo homem.
- Grupo 4 (IVB). En este grupo está la llamada “familia del titanio”, compuesta por los elementos titanio (Ti), circonio (Zr), hafnio (Hf) y rutherfordio (Rf), este último sintético y radiactivo, por lo que a veces no es tomado em conta. Eles são metais altamente reativos, portanto, em certas apresentações, eles podem instantaneamente avermelhar e inflamar apenas ao entrar em contato com o oxigênio do ar.
- Grupo 5 (GB). Nesse grupo está a família do vanádio (V), encabeçada pelo vanádio (V) e acompanhada pelo nióbio (Nb), tântalo (Ta) e dúbnio (Db), este último produzido exclusivamente em laboratórios. Eles são sólidos à temperatura ambiente, de cor prateada e conduzem calor e eletricidade.
- Grupo 6 (VIB). Nesse grupo está a família do cromo (Cr), composta por cromo (Cr), molibdênio (Mo), tungstênio (W) e seaborgio (Sg). São sólidos com alto ponto de fusão e ebulição, condutores de calor e eletricidade, altamente resistentes à corrosão e bastante reativos.
- Grupo 7 (VIIB). Nesta família estão o manganês (Mn), o tecnécio (Tc) e o rênio (Re), além do elemento de número atômico 107, o bório (Bh). Este último foi sintetizado pela primeira vez em 1981 e é altamente instável, de modo que sua meia-vida é de apenas 0,44 segundos. Em termos gerais, o rênio e o tecnécio também são elementos extremamente raros: o tecnécio não possui formas estáveis, enquanto o manganês é muito comum na natureza.
- Grupo 8 (VIIIB). Neste grupo está a família do ferro (Fe), que inclui o rutênio (Ru), o ósmio (Os) e o hássio (Hs). Hassium era conhecido como unniloctio e foi sintetizado em 1984 pela primeira vez; Está listado entre os elementos polêmicos 101 a 109, cuja nomenclatura tem sido questionada. São elementos bastante reativos, bons condutores de calor e eletricidade e, no caso do ferro, magnéticos.
- Grupo 9 (VIIIB). Neste grupo está a família do cobalto (Co), que contém os elementos cobalto (Co), ródio (Rh), irídio (Ir) e meitnério (Mt). Como no grupo anterior, o primeiro é ferromagnético e representativo das propriedades da família, e o último é sintético, por isso não existe na natureza (seu isótopo mais estável dura cerca de 10 anos).
- Grupo 10 (VIIIB). Nas versões anteriores da Tabela Periódica, esse grupo compunha uma única família, com os grupos 8 e 9. Versões recentes os separavam. Este grupo é encabeçado pelo níquel (Ni), acompanhado pelo paládio (Pd), platina (Pt) e darmstadtium (Ds). São metais comuns encontrados na natureza na forma elementar, embora o níquel (o mais reativo) possa ser encontrado em uma liga (especialmente em alguns meteoritos). Suas propriedades catalíticas tornam esses metais um importante suprimento para as indústrias química e aeroespacial.
- Grupo 11 (IB). A família do cobre (Cu) está neste grupo e é formada pelo cobre (Cu) e pelos metais preciosos ouro (Au) e prata (Ag) e roentgênio (Rg). Eles também são conhecidos como “metais de moedas”. Eles são pouco reativos, difíceis de corroer, macios e extremamente úteis para o homem.
- Grupo 12 (IIB). Este grupo contém a família do zinco (Zn), que contém zinco, cádmio (Cd), mercúrio (Hg) e copernicium (Cn), anteriormente chamado ununbium. São metais macios (na verdade, o mercúrio é o único metal líquido à temperatura ambiente), diamagnéticos e bivalentes, com os pontos de fusão mais baixos de todos os metais de transição. O curioso é que o zinco é muito necessário para a química da vida, enquanto o cádmio e o mercúrio são altamente intoxicantes. O Copernicium, por sua vez, é um elemento sintético criado em 1996.
- Grupo 13 (IIIA). Nesse grupo estão os elementos conhecidos como “terrosos”, pois são abundantes na terra, principalmente o alumínio. O grupo é encabeçado pelo boro (B), que é um metalóide, e depois pelo alumínio (Al), gálio (Ga), índio (In), tálio (Ta) e nihônio (Nh), cada vez mais metálicos à medida que desce na coluna. E embora o boro tenha alta dureza e propriedades não metálicas, o restante são metais macios e maleáveis amplamente utilizados pelo homem.
- Grupo 14 (IVA). Neste grupo estão os elementos carbonóides, encabeçados pelo carbono (C), e continuando com o silício (Si), germânio (Ge), estanho (Sn), chumbo (Pb) e flevorium (Fl). São elementos bem conhecidos, principalmente o carbono, essencial para toda a química da vida. Conforme você desce na família, no entanto, os elementos adquirem propriedades metálicas, a ponto de o carbono ser não metálico, o silício e o germânio semimetais, e o último claramente metálico.
- Grupo 15 (VA). Nesse grupo estão os elementos nitrogenados, encabeçados pelo nitrogênio (N), depois pelo fósforo (P), arsênico (As), antimônio (Sb), bismuto (Bi) e moscóvio (Mc), um elemento sintético. Também conhecidos como pnicogênios ou nitrogenóides, são altamente reativos em altas temperaturas e muitos são indispensáveis para a química orgânica.
- Grupo 16 (VIA ). Neste grupo estão os chamados calcógenos ou anfigenes. Esta é a família do oxigênio (O), que contém oxigênio (O), seguido de enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e fígado (Lv). Eles são caracterizados por terem seis elétrons de valência, apesar de suas propriedades variarem de não metálicas a metálicas à medida que seu número atômico aumenta. À temperatura ambiente, o oxigênio é um gás muito reativo devido ao seu pequeno tamanho, enquanto o resto dos elementos são sólidos e menos comuns na natureza.
- Grupo 17 (VIIA). Nesse grupo está a família dos halogênios, nome que vem de sua tendência a formar sais (haletos). Isso se deve ao fato de serem geralmente moléculas diatômicas com considerável poder oxidante, o que as leva a constituir íons mononegativos. São amplamente utilizados na indústria química e na fabricação de insumos para laboratórios. Esses elementos são flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At) e teneso (Ts), sendo este último também um metal do grupo f.
- Grupo 18 (VIIIA). Neste grupo estão os elementos conhecidos como “gases nobres” ou “gases inertes”. São elementos com baixíssima reatividade, que geralmente se encontram na forma de gases monoatômicos, inodoros, incolores, insípidos, formando pouquíssimos e excepcionais compostos, pelo fato de sua camada mais externa de elétrons estar completa. Esses elementos são hélio (He), néon (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe), radônio (Rn) e oganeson (Og). Estes dois últimos são particulares: o radônio é radioativo e não possui isótopos estáveis (seu isótopo mais estável é 222Rn, que existe há apenas 3,8 dias), enquanto o oganês é de origem sintética e o elemento mais pesado criado até hoje.
blocos da tabela periódica
Outra forma de entender a tabela periódica é através de seus quatro blocos:
- blocos. Compreende os dois primeiros grupos, ou seja, metais alcalinos e metais alcalino-terrosos, além de hidrogênio e hélio.
- Bloco p. Inclui os últimos seis grupos, ou seja, de 13 a 18 na Tabela Periódica e também todos os metalóides.
- bloco d. Inclui os grupos 3 a 12 e todos os metais de transição.
- Bloco f. Inclui terras raras (lantanídeos) e actinídeos. Não possui números de grupo próprios, embora se suponha que esses elementos pertenceriam ao 3.
- bloco g. Um bloco hipotético, no qual iriam os elementos que conseguirem ser sintetizados no futuro.
- hidretos
- hidrácidos
- Oxácidos
