o difusión É um processo físico que se baseia no fluxo de partículas de uma espécie química de uma região de maior concentração dessa espécie para uma região de menor concentração. Esse processo ocorrerá até que a concentração em ambas as regiões seja a mesma.
A difusão geralmente ocorre em líquidos e gases. Por exemplo, ele aroma de uma refeição ao entrar numa divisão é consequência da difusão de uma mistura de dois gases, ou seja, as partículas gasosas do alimento (o aroma) penetram na divisão, que inicialmente continha apenas ar. Dessa forma, eles se difundem até que a concentração dessas partículas seja a mesma dentro e fora da sala.
Algumas características de uma difusão:
- É produzido de uma concentração de soluto mais alta para uma zona de concentração de soluto mais baixa.
- É um processo gradativo, pois as partículas da substância que se difunde podem sofrer diversas modificações enquanto ocorre o processo. Além disso, é um tipo de transporte passivo, ou seja, não é necessário aplicar energia externa para que ocorra.
- A velocidade de difusão dependerá da massa e tamanho das partículas de cada substância. Existem gases pesados cuja difusão é mais lenta e outros (gases mais leves) cuja difusão é mais rápida.
- Misturas de gases
Exemplos de Difusão

- O perfume das flores num lugar fechado.
- Um aroma que se espalha por uma sala.
- Sentido: Uma pessoa perfumada que entra em uma sala e todos podem sentir seu perfume.
- A fumaça emitida pelos carros em circulação.
- Fumaça de chaminés em casas ou fábricas.
- O cheiro de comida podre dentro da geladeira.
- O cheiro de uma vela perfumada, incenso ou fósforo.
- Fumaça de um cigarro em uma sala hermética.
- essências aromáticas.
- O cheiro de ovo podre dentro de um recipiente.
o derramamento
o efusão É o processo pelo qual um gás escapa para fora de um recipiente através de uma pequena abertura ou fenda. A taxa de efusão é diretamente proporcional à velocidade média das partículas de gás.
Isso significa que se um molécula de gas pesado efusão, ela o fará mais lentamente do que uma molécula de gás mais leve, caso em que a efusão será mais rápida. Por exemplo: balão murcho.
Lei de Graham
Se as condições de pressão e temperatura forem as mesmas, o taxa de difusão e efusão dos gases é inversamente proporcional às raízes quadradas de suas massas molares.
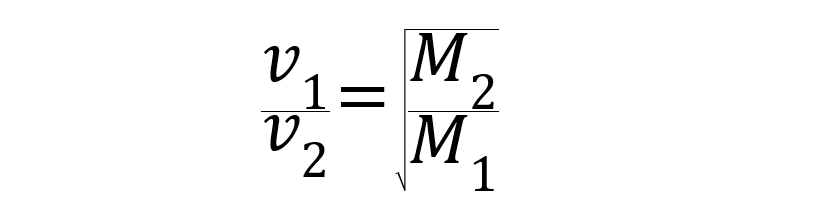
Sendo v1 y v2 as velocidades dos gases 1 e 2 expressas em metros por segundo (m/s), e M1 y M2 as massas molares dos gases 1 e 2 expressas em quilogramas por mole (kg/mol).
Exemplos de derrame

- Pressionando o botão em um desodorante.
- Gire o botão do queimador para ligá-lo ou desligá-lo.
- Uma lata de hélio com vazamento.
- Um balão de ar quente que apresenta uma perda.
- Mochilas de propulsão.
- Os tubos de gás dos astronautas.
- Um balão esvaziando.
- Uma flatulência.
- A separação do urânio-238 em urânio-235-
- Cilindro de gás com uma pequena fuga por onde este gás se desloca para outro compartimento ou para o exterior.
- Solubilidade
- difusão e osmose
- gás ideal e gás real
